Reacciones químicas, Óxidos y número de oxidación
Fenómenos físicos y químicos
Se deben diferenciar lo que son los cambios físicos de los cambios químicos.
Cambios físicos:
Las sustancias antes y después de que estos ocurran son las mismas.
Ejemplos:
Al evaporar agua esta se transforma en vapor, sus propiedades son distintas pero sigue siendo la misma sustancia lo mismo ocurre si se la congela y se transforma en hielo, ambos proceso son fácilmente reversibles, basta con condensar por enfriamiento el vapor o calentar el hielo para volver a tener agua líquida, lo mimo ocurre si por ejemplo se funde un metal y posteriormente se lo enfría, estos fenómenos son cambios de estado.
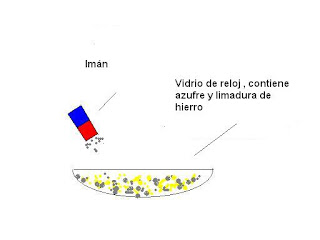
La mezclas de sustancias también son cambios físicos, y aprovechando sus diferentes propiedades es relativamente fácil separarlas, por ejemplo si se mezcla viruta de madera con arena bastará con colocarlas en un recipiente con agua para separarlas, debido a las diferentes densidades, la arena se hundirá y la viruta flotará, si se mezclan alcohol y agua se los podrá volver a separar destilándolos puesto que el punto de ebullición del alcohol es menor que el del agua; si se mezcla azufre con hierro se puede utilizar un imán para separarlos. No todos los cambios físicos son tan fácilmente reversibles como en los ejemplos anteriores, si se rompe un cristal no es posible revertir el proceso.
Cambios químicos:
Cuando ocurre una reacción química las sustancias antes y después de que esta ocurra son distintas, y el proceso es irreversible o muy difícil de revertir.
Cuando se quema el gas de la cocina ocurre aproximadamente la siguiente reacción:
CH4 +2 O2→ CO2 +2 H2O
metano + oxígeno ____ dióxido de carbono + agua
(En realidad la reacción es más compleja puesto que el gas no es solamente metano sino que hay otras sustancias, cabe mencionar que el gas natural no tiene olor, el que se percibe en el gas es debido a que sele agregan sustancias llamadas mercaptanos, esto se hace por razones de seguridad, para que sea posible advertir cuando hay una pérdida).
Esta reacción es exotérmica puesto que al producirse libera calor.
Anteriormente se mencionó como ejemplo de mezcla la de azufre con hierro, si a esta mezcla se la coloca en un tubo de ensayo y se la calienta en un mechero se produce una reacción química y luego de que esta ocurre ya no se pueden separar fácilmente el azufre del hierro, la reacción que ocurre es la siguiente:
S + Fe → Fe S
Azufre + hierro →Sulfuro de hierro II
Esta reacción no libera calor al producirse sino que por el contrario lo necesita para que ocurra, es una reacción endotérmica.
En la mezcla las sustancias y/o elementos conservan sus propiedades , en la reacción química cambian . En este caso se observa que cambian la consitencia, el color y el olor, el sulfuro de hierro que se forma despide un olor fétido, similar al de las bombitas de olor.En toda reacción química las sustancias presentes antes de que esta ocurra se llaman reactivos, y las que se producen luego de la reacción productos, en el ejemplo anterior el azufre y el hierro son reactivos y el sulfuro de hierro es producto.
En las reacciones químicas cambian las sustancias presentes antes y después de que estas ocurran pero la cantidad y el tipo de átomos de cada elemento son los mismos, si se observa la reacción en la que se produce la combustión del gas metano se ve que hay colocados un 2 delante de la molécula de oxígeno y otro 2 delante de la de agua, estos coeficientes se colocan para equilibrar o balancear la ecuación química de modo tal que haya la misma cantidad de átomos de cada elemento en los reactivos que en los productos, y en este caso significa que en la reacción por cada molécula de metano que reacciona hacen falta dos de oxígeno y se obtienen como productos una molécula de dióxido de carbono y dos de agua, los coeficientes deben colocarse siempre antes de la fórmula química .
Ejemplo:
Al + H Cl → Al Cl3 + H2
Aluminio + ácido clorhídrico Õ cloruro de aluminio + hidrógeno
A esta reacción falta equilíbrala puesto que en los reactivos hay un átomo de cloro y en los productos tres, además en los reactivos hay un átomo de hidrógeno y en los productos dos se deben colocar los coeficientes adecuados:
2 Al + 6 H Cl → 2 Al Cl3 + 3 H2
Ahora está equilibrada puesto que hay la misma cantidad de átomos de cada elemento en los reactivos y en los productos, esta reacción también libera calor aunque no se trate de una combustión como en el caso del metano.
ÓxidosSon compuestos binarios, formados por dos elementos, uno de los cuales es el oxígeno, en algunos casos son útiles como tales, el óxido de calcio es la cal, el dióxido de carbono es el gas de las gaseosas, otros se usan como materia prima para obtener metales como los óxidos de hierro. Una primera clasificación es la siguiente:
Óxidos ácidos:
No-metal + oxígeno → óxido ácido
Se forman por uniones covalentes, la mayoría son gaseosos y por reacción con agua forman ácidos. ( Como el ácido sulfúrico).
Óxidos básicos:
Metal + oxígeno→ óxido básico.
Sus uniones son iónicas, son sólidos, y por reacción con agua forman hidróxidos, también llamados bases o álcalis. (Como la soda cáustica o hidróxido de sodio).
Número de oxidación
Es el Número de electrones que un átomo de un elemento cede o tiende a ceder según su electronegatividad al combinarse con otro elemento. Cuando gana electrones el número de oxidación es negativo, (la ganancia de electrones se denomina reducción).
Los números de oxidación figuran en la tabla periódica como estados de oxidación, pero no todos los casos.
En la definición anterior ceder es para el caso de los enlaces iónicos, y tiende a ceder en el caso de los enlaces covalentes.
En la tabla periódica puede observarse que hay elementos que tienen un único estado de oxidación tal como en los casos de los metales alcalinos y alcalinoterreos (grupos 1 y 2), y este coincide con la cantidad de electrones de la última capa. En los metales de transición tales como el cobre y el hierro actúan con dos estados de oxidación, esto se debe a que pueden ceder electrones de la penúltima capa.
En muchos no metales como en los casos de azufre, del cloro entre otros se puede observar que poseen varios estados de oxidación que difieren en 2 (ejemplo el azufre -2, -4 y- 6) esto se debe a la posibilidad de formar enlaces covalentes dativos o coordinados.
Otros tipos de óxidos
Óxidos anfóteros
Los forman algunos metales de transición como el Zinc, Aluminio, Estaño y Plomo, reaccionan como óxidos ácidos en medio básico y como óxidos básicos en medio ácido. Sus uniones se consideran iónicas.
Óxido neutro
El monóxido de carbono C O no reacciona con el agua, es extremadamente venenoso se produce debido a una combustión incompleta.
Óxido salino
Son mezclas de óxidos tal como se encuentran en la naturaleza, Fe3 O4, (magnetita) es una mezcla de óxido ferroso o de hierro II y óxido férrico o de hierro III
Peróxidos
Son óxidos en los que el oxígeno actúa con número de oxidación –1, ejemplos: peróxido de hidrógeno o agua oxigenada H2O2, peróxido de sodio Na2 O2. , peróxido de potasio K2O2
En estas sustancias los átomos de oxígeno se unen entre sí de modo tal que comparten un electrón con lo cual a cada uno le queda la posibilidad de aceptar o compartir un electrón proveniente del otro elemento que forma el peróxido
Nomenclatura:
Para los óxidos básicos y anfóteros en los que los metales actúan con mas de un número de oxidación, se usa la siguiente:
Ejemplo:
Cobre con estado de oxidación 1 (el menor) Cu2 O: óxido cuproso o de cobre I
Cobre con estado de oxidación 2 (el mayor) Cu O: óxido cúprico o de cobre II
Para los óxidos ácidos se usa la siguiente:
Ejemplos:
N2 O5: Pentóxido de dinitrógeno, SO3: trióxido de azufre, Cl2O7 heptóxido de dicloro en que los prefijos indican la cantidad de átomos de no-metal y de oxígeno que forman la molécula.
(Hacer "click" en la imagen para verla)
O Hetpóxido de dicloro
Representación de fórmulas:
Se “cruzan” y cuando son pares se simplifican (excepto en los peróxidos) los números de oxidación (prescindiendo del signo) ejemplos:
Óxido de plomo IV o plúmbico
Óxido de aluminio
(No es reacción)
óxido de sodio
- Hierro con estado de oxidación +3 y oxígeno con estado de oxidación - 2
Fe2 O3. óxido de hierro III o férrico
Azufre con estado de oxidación + 6 y oxígeno con estado de oxidación - 2
SO3 Trióxido de azufre
Reacciones de formación
Se representa la reacción con oxígeno (molécula diatómica) y se balancea con los coeficientes.
Ejemplos: (M significa un metal cualquiera)
Para metales con número de oxidación +1, (por ejemplo el sodio Na)
Para metales con número de oxidación +2, (por ejemplo el calcio Ca)
2 M + O2 → 2 MO
Para metales con número de oxidación +3, (por ejemplo el aluminio Al)
Para metales con número de oxidación + 4, (por ejemplo el plomo Pb)
M + O2 →MO2
(En realidad los procesos de oxidación y en general de corrosión son más complejos puesto que son favorecidos por la presencia de agua y más aun de agua salada, aunque en los procesos de corrosión a alta temperatura no interviene el agua).
Para los óxidos ácidos el procedimiento es similar teniendo en cuenta los nros. de oxidación con que actúan.
En los óxidos del nitrógeno, del cloro (y de otros halógenos) se parte de estas sustancias como moléculas diatómicas porque es el estado en que existen: N2, Cl2
Ejemplo:
2 N2 + 5 O2 → 2 N2 O5
Ampiar ver